Nat.Common.|水环境中单个脂质囊泡毫秒级光开关变化过程的红外纳米光学观测
发布时间:2025年7月30日 分类:科普资讯 浏览量:295
投稿:张天宇
近日,来自德国慕尼黑大学(LMU)物理系的A. Tittl、T. Lohmüller、F. Keilmann研究团队,联合开发了一种基于散射型扫描近场光学显微镜(s-SNOM)的瞬态红外纳米成像技术,实现了对水性环境中单个脂质囊泡(最小176nm)光异构化动态的无标记、非破坏性观测,时间分辨率达30ms,空间分辨率达20nm。首次在单囊泡水平揭示了偶氮苯类光开关脂质(azo-PC)的瞬态/延迟异构化动力学,并量化了其形态变化(面积增加10%、圆形度降低8%)与化学结构转变的关联。
该研究成果以“Transient infrared nanoscopy resolves the millisecond photoswitching dynamics of single lipid vesicles in water”为题发表在国际知名学术期刊《Nature Communications》上。论文通讯作者为A. Tittl、T. Lohmüller、F. Keilmann,论文第一作者为T. Gölz。c'cccccccccc
研究背景
1、脂质纳米载体的重要性:脂质囊泡(如脂质体、脂质纳米颗粒LNPs)是纳米医学的核心平台,可包载疏水药物实现靶向递送,已应用于mRNA疫苗(如新冠疫苗)等临床场景。其性能优化依赖于外部触发的精准释放机制(如光控释放),但需解决动态过程的高时空分辨率观测难题。
2、现有技术的局限性:1)荧光标记法:偶氮苯类分子会淬灭荧光,干扰异构化过程。2)传统显微镜:远场红外光谱空间分辨率低(~1μm),无法区分单囊泡;AFM、TEM等虽能观察形态,但缺乏化学特异性。3)动态监测缺口:光异构化发生在毫秒级,现有技术难以捕捉单囊泡的实时结构-化学耦合变化。
3、关键挑战:需开发一种无标记、高时空分辨率、化学特异性的技术,在生理环境中实时追踪单个纳米载体的动态行为。
主要创新点
1、技术突破-水相环境中单囊泡的高分辨化学成像:1)空间分辨率:20nm(比传统远场红外提升50倍),首次观察到176nm囊泡的形态细节。2)时间分辨率:30ms(比同类近场技术快100倍),捕捉到毫秒级异构化动态。
2、方法创新-无标记动态监测:1)无需荧光或同位素标记,通过MIR指纹峰(如1602cm⁻¹)直接区分trans/cis态,避免标记干扰。2)结合形态(AFM topography)与化学(红外光谱)数据,实现“结构-功能”同步分析。
3、发现创新-异构化动力学的非线性特征:1)突然加速现象:trans→cis异构化在延迟10-15s后出现1 s内的快速跃迁,可能源于膜内脂质的协同效应(H-聚集体解体)。2)形态-化学耦合:cis态囊泡面积增加10%、圆形度降低8%,与分子堆积密度降低(cis体积增加25%)直接相关。
研究内容和结果
图1 系统展示了基于散射型扫描近场光学显微镜(s-SNOM)的实验方法与原理验证。
图1a 为膜基原位s-SNOM技术的工作示意图:10nm厚的SiN膜将AFM探针与水相环境中的脂质囊泡分离,既避免了探针污染,又通过范德华力固定囊泡以维持长期稳定性。MIR激光(红色区域)聚焦于探针尖端产生局域近场,穿透SiN膜探测下方100nm深度的囊泡;UV/蓝光LED(蓝色区域)则均匀照射膜表面,诱导脂质光异构化。图1b 补充了实验装置细节,包括抛物面镜聚焦光路、Michelson干涉仪检测散射光振幅(s2)和相位(φ2)的设计。
图1c 呈现了囊泡的化学组成:50:50混合的DOPC(常规脂质)与trans-azo-PC(光开关脂质),并通过分子结构示意图展示了azo-PC在365nm(trans→cis)和465nm(cis→trans)光照下的构象转变——cis态苯环由反式变为顺式,分子体积增加约25%。图1d 的UV-VIS光谱验证了切换波长的选择:trans态在365nm有强吸收,cis态在465nm有特征峰。
图1e 和 图1f 为核心实验结果。图1e 是trans态囊泡的光谱平均MIR振幅图像(s2),清晰显示直径约500nm的囊泡轮廓(比例尺500nm)。图1f 对比了同一囊泡在trans(蓝色)和cis(紫色)态的纳米FTIR相位光谱,发现1606cm⁻¹处的苯环呼吸峰强度在cis态显著降低,与ATR-FTIR结果一致,证实了该技术区分分子异构态的化学特异性。此外,1742cm⁻¹处的羰基峰强度无变化,排除了激光功率或 alignment 偏差的干扰。
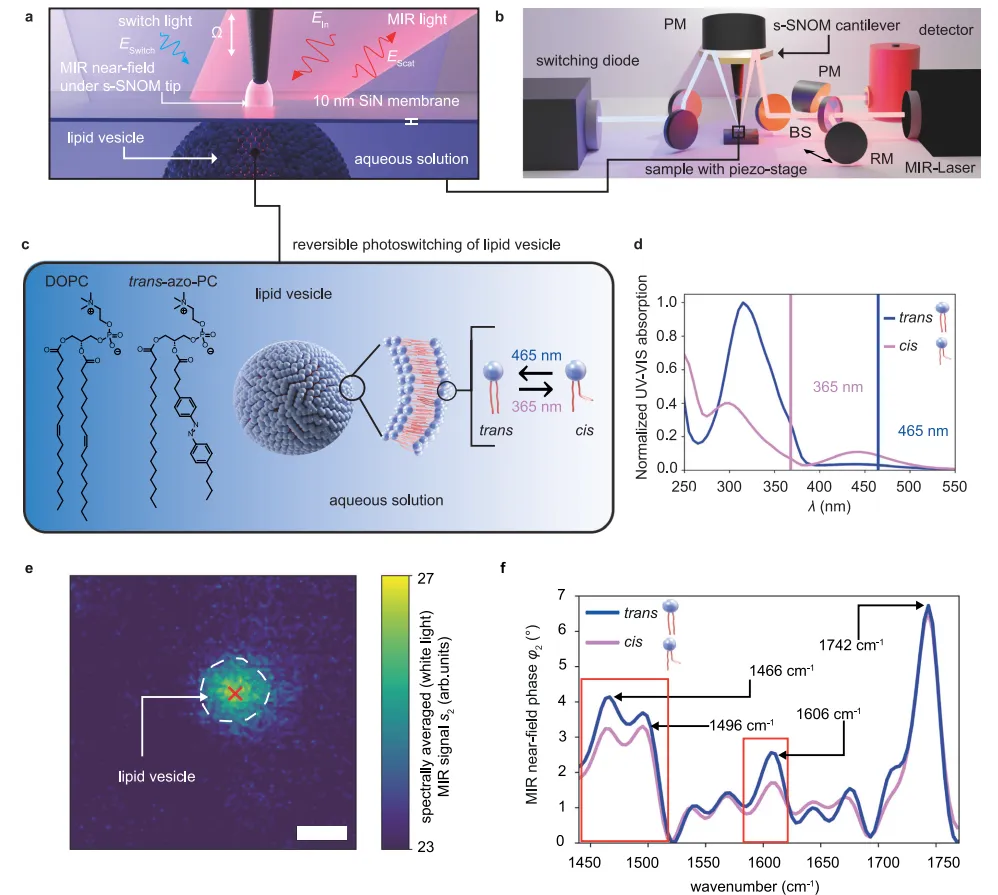
图2 聚焦于s-SNOM对多个囊泡的高分辨率成像能力,验证了技术的空间分辨极限。
图2a 和 图2b 分别为15μm×15μm区域内囊泡的MIR振幅(s2)和相位(φ2)图像,探测波长1730cm⁻¹(羰基共振)。结果显示,即使在水相环境中,不同尺寸的囊泡(直径176nm至数微米)仍可被清晰识别,且相位信号(φ2 > 25°)在囊泡内部均匀分布,边缘呈现约100nm宽的fringe(白色环)。
图2c 为四个代表性囊泡的放大相位图像(比例尺300nm),图2d 提取了沿囊泡中心的相位轮廓并通过高斯拟合计算半高全宽(FWHM)。数据显示,最小囊泡的FWHM为176nm,接近系统的空间分辨率极限(100-150nm),远优于传统远场红外显微镜(~5μm)。
这一结果证实,s-SNOM可在生理环境下对亚200nm的纳米载体进行形态表征。此外,通过对比实验相位轮廓与非变形球体的理论模型,发现囊泡在SiN膜上发生扁平化——膜向上位移1-2nm(机械图像佐证),这与近场探测深度(~100nm)仅敏感于4nm厚的吸附脂质膜一致,为后续动态研究中囊泡形态变化的量化奠定了基础。
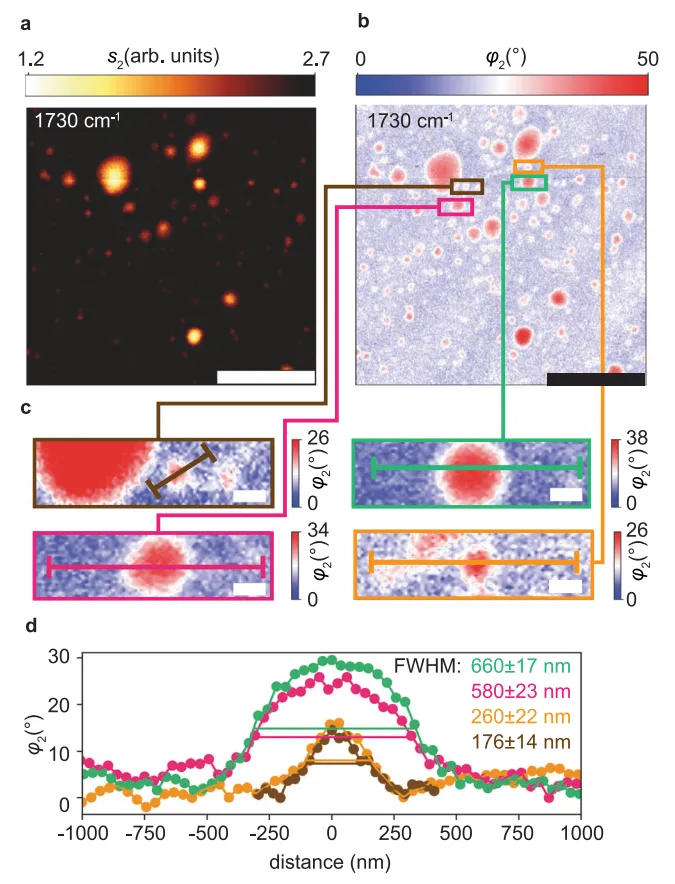
图3 通过时间序列成像,直观展示了光异构化诱导的囊泡形态动态变化。
图3a(振幅s2)和 图3b(相位φ2)记录了同一囊泡在1603cm⁻¹(偶氮苯特征峰)处的多次切换循环:初始trans态囊泡呈圆形,经365nm光照后(cis态)形态显著变形,再经465nm光照恢复(trans态),此过程可重复至少4个循环(1小时内),证实了切换的可逆性与测量稳定性。
图3c 定义了形态量化指标:面积(A)和圆形度(4πA/p²,p为周长),其中圆形度=1表示理想圆形,值越小越不规则。通过设定s2=7.8 arb.units的阈值分割囊泡边界,图3d 量化了两个切换循环中的形态变化:trans→cis转变导致囊泡面积增加10%,圆形度降低8%(从0.85降至0.78)。
这一结果与azo-PC分子cis态体积增加(20-25%)导致膜堆积密度降低的物理机制一致,同时支持了“cis态膜弯曲刚度更低易变形”的假设。值得注意的是,形态变化与光谱信号变化同步,表明s-SNOM可同时捕捉化学结构(红外光谱)与物理形态(图像)的动态关联,为研究光控纳米载体的构效关系提供了直接证据。
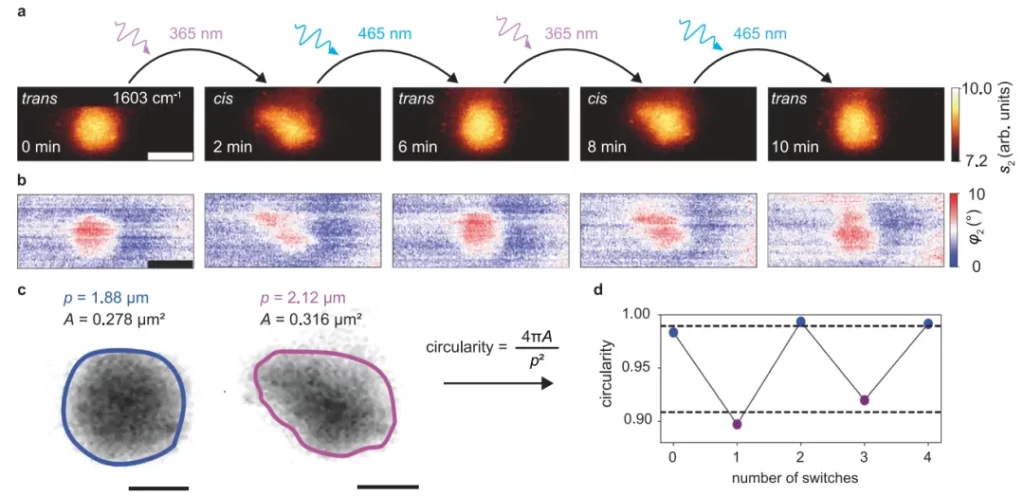
图4 通过瞬态信号记录,揭示了光异构化的毫秒级动力学特征,突破了扫描成像的时间分辨率限制。
图4a 和 图4d 为实验前囊泡的振幅/相位图像(1603cm⁻¹),探针固定于囊泡中心(红叉)以避免位置偏差。图4b 和 图4e 展示了8次切换循环(365nm/465nm交替光照)的信号时间轨迹,采样时间500ms:trans→cis时,振幅(s2)下降8%,相位(φ2)降低1.6°;cis→trans时信号对称恢复,重复精度>95%。
对信号轨迹进行sigmoidal函数拟合(红色曲线),提取关键动力学参数:延迟时间td=10.3-15.7s(光照开始至信号突变的时间),生长参数τ=0.7-3.9s(信号突变的速率)。其中τ与采样时间(500ms)处于同一量级,提示实际异构化速率可能更快。此外,信号突变常发生在3-4个数据点(1.5-2s)内,暗示膜内脂质存在协同效应——trans态H-聚集体解体后,cis态分子快速重排,导致“延迟-爆发”式动力学行为。
图4c 和 图4f 为实验后囊泡的成像验证,确认其位置和信号强度无漂移,排除了机械 artifacts。控制实验(D2O背景、硅片表面)进一步证实信号变化源于脂质异构化而非光照干扰。该方法最终实现了30 ms的采样时间(信噪比4σ),为毫秒级生物动态过程的研究开辟了新途径。
总结与展望
本研究为纳米尺度动态过程的观测提供了“可视化工具”,其技术创新(水相近场红外瞬态成像)和生物学发现(脂质膜协同异构化)对纳米医学、生物物理和材料科学领域具有交叉启发意义。
1、核心结论:1)技术验证:s-SNOM瞬态红外纳米成像可在水性环境中实现单囊泡的无标记、高时空分辨分析。2)机制阐明:光异构化诱导脂质膜从有序(trans-H聚集体)到无序(cis-松散堆积)的转变,导致囊泡形态重塑与动力学非线性。3)量化数据:空间分辨率:20nm;时间分辨率:30ms;异构化延迟时间:10.3-15.7s;响应速率:0.7-3.9s;囊泡面积变化:+10%(trans→cis);圆形度变化:-8%(trans→cis)。
2、局限性:1)膜支撑影响:SiN膜可能导致囊泡扁平化(实验观察到1-2nm膜位移),需进一步优化样品体系。2)时间分辨率瓶颈:30ms仍受限于探测器响应速度,未来可通过更亮的MIR光源(如同步辐射)突破至微秒级。
3、未来展望:1)生物医学应用:拓展至mRNA-LNPs的释放动力学研究,优化光控药物递送系统。2)技术拓展:结合微流控芯片实现动态环境(pH、温度变化)下的实时监测。3)跨学科价值:为金属有机框架(MOFs)、2D材料等纳米系统的动态研究提供通用平台。
论文信息:Gölz, T., Baù, E., Zhang, J. et al. Transient infrared nanoscopy resolves the millisecond photoswitching dynamics of single lipid vesicles in water. Nat Commun 16, 6033 (2025). https://doi.org/10.1038/s41467-025-61341-9



 川公网安备51019002007618号
川公网安备51019002007618号








